Bài giảng Hóa đại cương - Chương 10: Phân nhóm VIIB
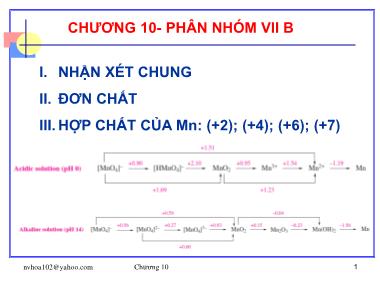
I. NHẬN XÉT CHUNG
II. ĐƠN CHẤT
III. HỢP CHẤT CỦA Mn: (+2); (+4); (+6); (+7)
I.NHẬN XÉT CHUNG
- Các nguyên tố PN VIIB gồm Mn, Tc, Re.
- Cấu hình e’ hóa trị giống nhau: (n1)d5ns2, nên:
X –ne’ → X (+2, , +7)
thể hiện tính kim loại.
- Số oxyhóa dương đặc trưng, bền +7. Riêng Mn còn có
các số oxyhóa đặc trưng và bền là +2, +4.
- Ở số oxyhóa dương thấp chúng giống KL Fe, Cr ,
- Ở số oxyhóa dương cao có tính chất giống PK (Clo)
II.ĐƠN CHẤT
- Mn là KL hoạt động:
- Bột Mn dễ bị PK oxyhóa ở điều kiện thường hay khi đốt
nóng:
Mn + Cl2 MnCl2
Mn + S MnS (to)
- Mn đẩy được H2 ra khỏi nước, dễ tan trong axit loãng:
Mn + 2H2O Mn(OH)2 + H2 (100oC)
Mn + HCl MnCl2 + H2
Bạn đang xem tài liệu "Bài giảng Hóa đại cương - Chương 10: Phân nhóm VIIB", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa đại cương - Chương 10: Phân nhóm VIIB
nvhoa102@yahoo.com Chương 10 1 CHƯƠNG 10- PHÂN NHÓM VII B I. NHẬN XÉT CHUNG II. ĐƠN CHẤT III. HỢP CHẤT CỦA Mn: (+2); (+4); (+6); (+7) nvhoa102@yahoo.com Chương 10 2 - Các nguyên tố PN VIIB gồm Mn, Tc, Re. - Cấu hình e’ hóa trị giống nhau: (n 1)d5ns2, nên: X –ne’ → X (+2,, +7) thể hiện tính kim loại. - Số oxyhóa dương đặc trưng, bền +7. Riêng Mn còn có các số oxyhóa đặc trưng và bền là +2, +4. - Ở số oxyhóa dương thấp chúng giống KL Fe, Cr, - Ở số oxyhóa dương cao có tính chất giống PK (Clo) I.NHẬN XÉT CHUNG nvhoa102@yahoo.com Chương 10 3 II.ĐƠN CHẤT - Mn là KL hoạt động: - Bột Mn dễ bị PK oxyhóa ở điều kiện thường hay khi đốt nóng: Mn + Cl2 MnCl2 Mn + S MnS (to) - Mn đẩy được H2 ra khỏi nước, dễ tan trong axit loãng: Mn + 2H 2 O Mn(OH) 2 + H 2 (100oC) Mn + HCl MnCl 2 + H 2 nvhoa102@yahoo.com Chương 10 4 - quặng pyroluzit MnO2.nH2O. - Điều chế Mn từ MnO2: 3MnO2 = Mn3O4 + O2 (t o) 3Mn3O4 + 8 Al = 9Mn + 4Al2O3 (t o) Điều chế: II.ĐƠN CHẤT nvhoa102@yahoo.com Chương 10 5 III.CÁC HỢP CHẤT CỦA Mn 1.Mn(+2) - Hợp chất Mn(+2) có tính bazơ > axit - Có tính khử: phụ thuộc vào môi trường: Trong môi trường kiềm Mn(+4) 2Mn(OH) 2 + O 2 + 2H 2 O Mn(OH) 4 Trong môi trường kiềm nóng chảy MnO4 2- 3MnSO 4 +2KClO 3 +12KOH 3K 2 MnO 4 + 2KCl +3K 2 SO 4 +6H 2 O Trong môi trường axit MnO4 - 3MnSO 4 +5PbO 2 + 6HNO 3 2HMnO 4 + 3Pb(NO 3 ) 2 +2PbSO 4 +2H 2 O nvhoa102@yahoo.com Chương 10 6 –Phức cation aquơ màu hồng [Mn(H2O)6] 2+ dễ tạo thành trong dung dịch -Khi kết tinh sẽ được hyđrat màu hồng (SPT 6): Mn(NO3)2.6H2O, MnCl2.4H2O, MnSO4.4H2O - Các phức khác của Mn(+2) không đặc trưng, không bền. 1.Mn(+2) nvhoa102@yahoo.com Chương 10 7 2. Mn(+4) - Oxit , hidroxit của Mn (+4) bền hơn muối. -Khi cho oxit, hidroxit Mn(+4) tác dụng axit đặc Mn2+ MnO2 + 4HCl MnCl2 + Cl2 + 2H2O (đặc,to) 2Mn(OH)4 + 2H2SO4 2MnSO4 +O2 + 6H2O (đặc,to) - MnO2, Mn(OH)4 có tính lưỡng tính nhưng cả 2 tính đều yếu. MnO2 Mn(OH)4 nvhoa102@yahoo.com Chương 10 8 - Mn(+4): tính oxihóa MnO2 + HCl đặc MnCl2 + Cl2 + H2O (t 0) - Mn(+4) :tính khử: khi tác dụng với chất oxi hóa mạnh Trong môi trường kiềm: Mn (+4) MnO4 2- 2MnO 2 + 3PbO 2 + 6HNO 3 2HMnO 4 + 3Pb(NO 3 ) 2 + 2H 2 O 2MnO 2 + KClO 3 + 6KOH 3K 2 MnO 4 + KCl + 3H 2 O Trong môi trường axit: Mn (+4) MnO4 - 2.Mn(+4) nvhoa102@yahoo.com Chương 10 9 3.Mn(+6) MnO4 2- không đặc trưng, không bền. Muối MnO4 2- có màu lục sẫm, không bền bị phân hủy trong nước 3K 2 MnO 4 + 2H 2 O 2KMnO 4 + MnO 2 + 4KOH MnO4 2- có tính oxihóa mạnh Trong môi trường kiềm: MnO2 K2MnO4 + K2SO3 + H2O MnO2 + K2SO4 + 2KOH Trong môi trường axit Mn2+ K2MnO4 + K2SO3 + H2SO4 K2SO4 + MnSO4 + H2O nvhoa102@yahoo.com Chương 10 10 MnO4 2- thể hiện tính khử khi tác dụng với chất oxihóa mạnh. 2K 2 MnO 4 + Cl 2 2KMnO 4 + 2KCl Điều chế: MnO2 + kiềm chảy + chất oxi hóa MnO4 2- 2MnO 2 + 4KOH + O 2 2K 2 MnO 4 + 2H 2 O MnO 2 + K 2 CO 3 + KNO 3 K 2 MnO 4 + KNO 2 + CO 2 3.Mn(+6) nvhoa102@yahoo.com Chương 10 11 4.Mn(+7) HMnO4 tồn tại ở dạng dung dịch 20% bị phân hủy: HMnO4 MnO2 + O2 + H2O Muối MnO4 - bền hơn MnO4 2- Muối MnO4 - bị nhiệt phân ở khoảng 2500C 2KMnO 4 K 2 MnO 4 + MnO 2 + O 2 (250oC) Có tính oxihóa mạnh, phụ thuộc vào môi trường nvhoa102@yahoo.com Chương 10 12 Trong môi trường axit: Mn2+ Trong môi trường bazơ: MnO4 2- Trong môi trường trung tính: MnO2 5K 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 6K 2 SO 4 + 2MnSO 4 + 3H 2 O K 2 SO 3 + 2KMnO 4 + 2KOH K 2 SO 4 + 2K 2 MnO 4 + H 2 O 3K 2 SO 3 + 2KMnO 4 + H 2 O 3K 2 SO 4 + 2MnO 2 + 2KOH 4.Mn(+7) nvhoa102@yahoo.com Chương 10 13 Điều chế KMnO4: - Oxihóa MnO4 2- bằng Cl2 hay PbO2 – HNO3 - Điện phân dung dịch MnO4 2- 2K 2 MnO 4 +2PbO 2 +6HNO 3 2KMnO 4 +2Pb(NO 3 ) 2 +2KNO 3 +3H 2 O 4.Mn(+7) nvhoa102@yahoo.com Chương 10 14 1.Viết các phản ứng sau: a. MnO2 + HCl b. Mn(OH)4 + KClO3 + KOH c. MnCl2 + KClO3 + KOH d. MnSO4 + PbO2 + HNO3 e. Mn(OH)4 + HCl f. K2MnO4 + FeSO4 + H2SO4 g. KMnO4 + KI + H2O h. KMnO4 + Na2SO3 + H2O i. KMnO4 + Na2S2O3 + H2SO4 j. KMnO4 + Na2SO3 + KOH BÀI TẬP nvhoa102@yahoo.com Chương 10 15 2. Một dung dịch KMnO4 được chuẩn độ trong môi trường axit bằng 20ml dung dịch Na2C2O4 0,15N. Tính nồng độ đương lượng KMnO4. Dùng dung dịch KMnO4 ở trên xác định nồng độ của FeSO4. Cứ 10ml dung dịch FeSO4 cần dùng 14,6ml dung dịch KMnO4. Xác định nồng độ của FeSO4. BÀI TẬP nvhoa102@yahoo.com Chương 10 16 3. Hòa tan m g hỗn hợp hai muối FeSO4 và Fe2(SO4)3 trong nước đã được axit hóa bằng H2SO4 thành 1 lít dung dịch A. Cứ 100 ml dung dịch A được chuẩn độ bằng 100ml dung dịch KMnO4 0,1N. 100ml dung dịch A phản ứng vừa đủ với 0,996 g KI. Viết các phương trình phản ứng xảy ra. Tính khối lượng m đã dùng và thành phần phần trăm của hai muối trên. Cho Fe =56; S =32; O =16; H =1; K =39; Mn =55; I =127 BÀI TẬP
File đính kèm:
 bai_giang_hoa_dai_cuong_chuong_10_phan_nhom_viib.pdf
bai_giang_hoa_dai_cuong_chuong_10_phan_nhom_viib.pdf

