Bài giảng Hóa đại cương - Chương 12: Phân nhóm IIB
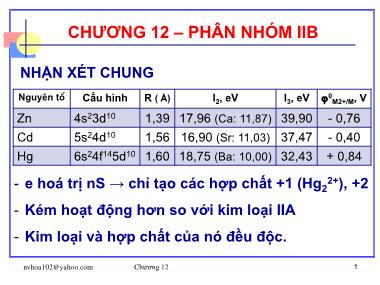
NHẬN XÉT CHUNG
Nguyên tố Cấu hình R ( Å) I2, eV I3, eV 0M2+/M, V
Zn 4s23d10 1,39 17,96 (Ca: 11,87) 39,90 - 0,76
Cd 5s24d10 1,56 16,90 (Sr: 11,03) 37,47 - 0,40
Hg 6s24f145d10 1,60 18,75 (Ba: 10,00) 32,43 + 0,84
- e hoá trị nS → chỉ tạo các hợp chất +1 (Hg22+), +2
- Kém hoạt động hơn so với kim loại IIA
- Kim loại và hợp chất của nó đều độc.
1. Đơn chất Zn, Cd, Hg
- Kim loại trắng hơi xanh, dễ nóng chảy, bay hơi
(Hg có nhiệt độ nóng chảy và sôi thấp nhất – ở đk
bình thường Hg là chất lỏng)
- Tạo hợp kim với nhau và với nhiều kim loại khác
1. Đơn chất Zn, Cd, Hg
- Đối với HCl, H2SO4 loãng: Zn tan dễ dàng, Cd tan
chậm, Hg không tan
Zn2+ + 2e Zn 0 = - 0,76 V
Cd2+ + 2e Cd 0 = - 0,4025 V
Hg2+ + 2e Hg 0 = + 0,84 V
- Đối với HNO3: đều dễ tan
6Hg + 8HNO3loãng 3Hg2(NO3)2 + 2NO + 4H2O
3Hg + 8HNO3loãng 3Hg(NO3)2 + 2NO + 4H2O
- Zn là kim loại lưỡng tính, tan trong axit và kiềm nóng
Zn + 2HCl + 4H2O H2 + [Zn(H2O)4]Cl2
Zn + 2NaOH + 2H2O H2 + Na2[Zn(OH)4]
Tóm tắt nội dung tài liệu: Bài giảng Hóa đại cương - Chương 12: Phân nhóm IIB
nvhoa102@yahoo.com Chương 12 1 CHƯƠNG 12 – PHÂN NHÓM IIB NHẬN XÉT CHUNG Nguyên tô ́ Cấu hình R ( Å) I2, eV I3, eV 0 M2+/M, V Zn 4s23d10 1,39 17,96 (Ca: 11,87) 39,90 - 0,76 Cd 5s24d10 1,56 16,90 (Sr: 11,03) 37,47 - 0,40 Hg 6s24f145d10 1,60 18,75 (Ba: 10,00) 32,43 + 0,84 - e hoá trị nS → chỉ tạo các hợp chất +1 (Hg2 2+), +2 - Kém hoạt động hơn so với kim loại IIA - Kim loại và hợp chất của nó đều độc. nvhoa102@yahoo.com Chương 12 2 CHƯƠNG 13 – PHÂN NHÓM IIB 1. Đơn chất Zn, Cd, Hg - Kim loại trắng hơi xanh, dễ nóng chảy, bay hơi (Hg có nhiệt độ nóng chảy và sôi thấp nhất – ở đk bình thường Hg là chất lỏng) - Tạo hợp kim với nhau và với nhiều kim loại khác Zn Cd Hg T0nc 0C 419,6 321 - 38,86 T0s 0C 906 767 356,66 nvhoa102@yahoo.com Chương 12 3 - Đối với HCl, H2SO4 loãng: Zn tan dễ dàng, Cd tan chậm, Hg không tan Zn2+ + 2e Zn 0 = - 0,76 V Cd2+ + 2e Cd 0 = - 0,4025 V Hg2+ + 2e Hg 0 = + 0,84 V - Đối với HNO3: đều dễ tan 6Hg + 8HNO3loãng 3Hg2(NO3)2 + 2NO + 4H2O 3Hg + 8HNO3loãng 3Hg(NO3)2 + 2NO + 4H2O - Zn là kim loại lưỡng tính, tan trong axit và kiềm nóng Zn + 2HCl + 4H2O H2 + [Zn(H2O)4]Cl2 Zn + 2NaOH + 2H2O H2 + Na2[Zn(OH)4] 1. Đơn chất Zn, Cd, Hg nvhoa102@yahoo.com Chương 12 4 Oxit: - ZnO, CdO rất bền nhiệt, HgO kém bền nhiệt 2HgO 2Hg + O2 (400 0 C) - Các XO không tan trong nước, có tính lưỡng tính hoạt bazo ZnO + 2NaOHđặc + H2O Na2[Zn(OH)4] CdO + NaOHrắn, nóng chảy Na2CdO2 + H2O HgO + 2HNO3 Hg(NO3)2 + H2O 2. Hợp chất (+2) nvhoa102@yahoo.com Chương 12 5 2. Hợp chất (+2) Hydroxyt: - Zn(OH)2 có tính lưỡng tính điển hình - Cd(OH)2 có tính bazo - Hg(OH)2 không tồn tại vì bị mất nước ngay khi tạo thành: Hg2+ + 2OH- HgO + H2O nvhoa102@yahoo.com Chương 12 6 Muối và phức chất: - Hg2+ có tính oxy hóa Hg(NO3)2 + Hg Hg2(NO3)2 HgCl2 + SO2 + 2H2O Hg + H2SO4 + 2HCl - Dễ tạo phức cation aquơ, amicat, halogeno, cyano với số phối trí đặc trưng 4 2. Hợp chất (+2) nvhoa102@yahoo.com Chương 12 7 - Trạng thái Hg(+1) tồn tại trong Hg2(NO3)2 ; Hg2Cl2 - Không có ion Hg+ mà có ion Hg2 2+ với cấu trúc [-Hg-Hg-]2+ 2 nguyên tử Hg có hóa trị 2 trong dung dịch vẫn tồn tại ion Hg 2 2+ Hg (+1) thể hiện tính oxi hóa và khử Hg2Cl2 + SnCl2 → 2Hg + SnCl4 Hg2Cl2 + SO2 + H2O → 2Hg + H2SO4 + 2HCl Hg2Cl2 + Cl2 → 2HgCl2 3Hg2Cl2 + 8HNO3 → 3HgCl2 + 3Hg(NO3)2 + 2NO + 4H2O 3. Hợp chất Hg(+1)
File đính kèm:
 bai_giang_hoa_dai_cuong_chuong_12_phan_nhom_iib.pdf
bai_giang_hoa_dai_cuong_chuong_12_phan_nhom_iib.pdf

