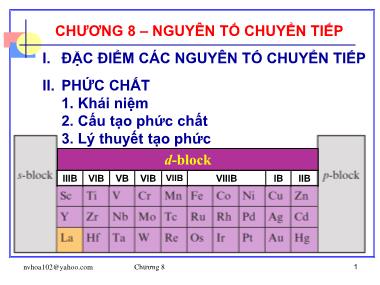
Bài giảng Hóa đại cương - Chương 8: Nguyên tố chuyển tiếp
I. ĐẶC ĐIỂM CÁC NGUYÊN TỐ CHUYỂN TIẾP
II. PHỨC CHẤT
1. Khái niệm
2. Cấu tạo phức chất
3. Lý thuyết tạo phức
I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP
I.1.Đặc điểm cấu tạo:
Các nguyên tố chuyển tiếp là các nguyên tố d (có e-
cuối cùng sắp xếp vào AO (n-1)d)
– Cấu hình electron hóa trị của nguyên tố d:
Nhóm III IV V VI
Cấu hình e (n1)d1ns2 (n1)d2ns2 (n1)d3ns2 (n1)d5ns1
Nhóm VII VIII I II
Cấuhình e (n1)d5ns2 (n1)d6,7,8ns2 (n1)d10ns1 (n1)d10ns2
- Số e’ hóa trị = số e’ phân lớp s lớp ngoài cùng
+ số e’ phân lớp d lớp kề lớp ngoài cùng = STT
của nhóm.
- Có 1 số ngoại lệ trong cấu trúc e’ ở PN VIB, IB,
IIB và PN VIIIB.
I.1.Đặc điểm cấu tạo:
I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa đại cương - Chương 8: Nguyên tố chuyển tiếp", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa đại cương - Chương 8: Nguyên tố chuyển tiếp
nvhoa102@yahoo.com Chương 8 1 CHƯƠNG 8 – NGUYÊN TỐ CHUYỂN TIẾP I. ĐẶC ĐIỂM CÁC NGUYÊN TỐ CHUYỂN TIẾP II. PHỨC CHẤT 1. Khái niệm 2. Cấu tạo phức chất 3. Lý thuyết tạo phức IIIB VIB VB VIB VIIB VIIIB IB IIB d-block nvhoa102@yahoo.com Chương 8 2 I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP I.1.Đặc điểm cấu tạo: Các nguyên tố chuyển tiếp là các nguyên tố d (có e- cuối cùng sắp xếp vào AO (n-1)d) – Cấu hình electron hóa trị của nguyên tố d: Nhóm III IV V VI Cấu hình e (n 1)d1ns2 (n 1)d2ns2 (n 1)d3ns2 (n 1)d5ns1 Nhóm VII VIII I II Cấuhình e (n 1)d5ns2 (n 1)d6,7,8ns2 (n 1)d10ns1 (n 1)d10ns2 nvhoa102@yahoo.com Chương 8 3 - Số e’ hóa trị = số e’ phân lớp s lớp ngoài cùng + số e’ phân lớp d lớp kề lớp ngoài cùng = STT của nhóm. - Có 1 số ngoại lệ trong cấu trúc e’ ở PN VIB, IB, IIB và PN VIIIB. I.1.Đặc điểm cấu tạo: I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP nvhoa102@yahoo.com Chương 8 4 I.2. Đặc tính chung - Chỉ có khả năng cho e Các KL - Có nhiều trạng thái oxihóa dương khác nhau và cách nhau 1 đơn vị: từ +1 đến STT nhóm - Số oxihóa dương cực đại = STT của nhóm (Ngoại lệ: Au, Cu) - Hợp chất có trạng thái oxihóa dương thấp (< 3): KL - Hợp chất có trạng thái oxihóa dương cao ( 4) : PK - Nguyên tố d dễ tạo thành các phức chất I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP nvhoa102@yahoo.com Chương 8 5 II. PHỨC CHẤT – Các phân tử, ion có thể kết hợp với nhau tạo PC: CoCl3 + 6NH3 = [Co(NH3)6]Cl3 Fe2+ + 6CN ̅ = [Fe(CN)6] 4 BF3 + F - = [BF4] - – Định nghĩa phức chất (ở trạng thái rắn và dung dịch): Phức chất là hợp chất ở nút mạng tinh thể có chứa các ion phức tích điện dương hay âm (ion phức) có khả năng tồn tại độc lập trong dung dịch. II.1. Khái niệm chung nvhoa102@yahoo.com Chương 8 6 Cấu trúc tinh thể lập phương của phức [Mn(NH3)6]Cl2 → N → Cl- → Mn2+ nvhoa102@yahoo.com Chương 8 7 Thành phần phức chất: Phức chất Cầu ngoại Cầu nội [M (L)n] ñt Chất tạo phức Phối tử Số PT Điện tích PC = Đt (M) + n. Đt (L) Ví dụ: [Co(NH3)6]Cl3 [Fe(H2O)6]Cl2 II. PHỨC CHẤT nvhoa102@yahoo.com Chương 8 8 Do tương tác tĩnh điện hoặc cho – nhận hoặc gồm cả 2 tương tác trên giữa nguyên tử trung tâm (M)và phối tử (L) Phân loại PC: Cation Anion Trung hòa [Co(H2O)6] 3+ [Al(OH)4] - [Fe(CO)5] [Co(NH3)3Cl3] Gọi tên PC : cation + anion phức hay cation phức + anion Liên kết trong phức chất: II. PHỨC CHẤT nvhoa102@yahoo.com Chương 8 9 Tên của ion phức: Số phối tử + tên phối tử + tên chất tạo phức + (số oxh) Phức cation : tên goi thường Phức anion: tên Latinh + at Phối tử là anion: tên anion + o F-: floro Cl-: Cloro OH-: hidroxo PT trung hòa: H2O: aquơ ; CO: cacbonyl NO: nitrozyl NH3: ammin 1: mono 2: di 3: tri 4: tetra 5: penta 6: hexa (I), (II) II. PHỨC CHẤT nvhoa102@yahoo.com Chương 8 10 Tên latinh của một số kim loại trong anion muối phức: II. PHỨC CHẤT Be – berilat B – borat Al – aluminat Sn – stanat Pb – plombat Sb - stibat Cu – cuprat Ag – acgentat Au – aurat Zn – zincat Hg – mecurat Cr - cromat Fe – ferat Co – cobantat Ni – nikelat Rh – rodat Pd – paladat Pt - platinat nvhoa102@yahoo.com Chương 8 11 Sự phân li của phức chất trong dung dịch K4[Fe(CN)6] 4K + + [Fe(CN)6] 4 [Fe(CN)6] 4 ⇌ Fe2+ + 6CN ̅ 2 6 ' 4 6 [ ][ ] 1 ( ) [ ( ) ] ( ) kb b Fe CN K Fe CN K Kkb càng lớn phức càng kém bền Kb càng lớn phức càng bền II. PHỨC CHẤT nvhoa102@yahoo.com Chương 8 12 II. PHỨC CHẤT Hằng số bền từng nấc và hằng số bền tổng Ni2+ + NH3 [Ni(NH3)] 2+ [Ni(NH3)] 2+ + NH3 [Ni(NH3)2] 2+ ⁞ [Ni(NH3)5] 2+ + NH3 [Ni(NH3)6] 2+ Kb = Kb1 . Kb2 . Kb3 . Kb4 . Kb5 . Kb6 2 23 1 2 3 2 23 2 2 2 3 3 2 3 6 6 2 3 5 3 [ ( ) ] 4, 68.10 [ ] .[ ] [ ( ) ] 1,32.10 [ ( ) ].[ ] [ ( ) ] 0,81 [ ( ) ].[ ] b b b Ni NH K Ni NH Ni NH K Ni NH NH Ni NH K Ni NH NH nvhoa102@yahoo.com Chương 8 13 II. PHỨC CHẤT Độ bền của phức chất và độ tan của kết tủa AgCl(r) ⇌ Ag + (dd) + Cl - (dd) TAgCl = [Ag +].[Cl-] = 1,8.10-10 Ag+(dd) + 2NH3(dd) ⇌ [Ag(NH3)2] + (dd) K b = 10 8 AgCl(r) + 2NH3(dd) ⇌ [Ag(NH3)2] + (dd) + Cl - (dd) 10 8 23 2 2 3 [ ][ ( ) ] . 1,8.10 .10 1,8.10 [ ] cb AgCl b Cl Ag NH K T K NH Trong dung dịch NH3 1M, kết tủa AgCl sẽ tan nvhoa102@yahoo.com Chương 8 14 II. PHỨC CHẤT Ảnh hưởng của phản ứng tạo phức đến thế điện cực Fe2+ - e ⇌ Fe3+ (1) Khi có mặt F-: Fe3++6F-⇌ [FeF6]3- (2) Fe2+ + 6F- - e ⇌ [FeF6]3- 3 166 3 6 [ ] 10 [ ].[ ] FeF Fe F 3 2 0 / ( 0,77 ) Fe Fe V 3 0 ' 6 2 6 [ ] 0,059 lg [ ].[ ] FeF Fe F 3 6 2 6 [ ] 1 (3) [ ].[ ] FeF Fe F = 0’ khi: (3) : (2)⇒ 3 2 16 [ ] 1 [ ] 10 Fe Fe 3 2 3 2 3 0 2/ / [ ] 0,059 lg 0,17 [ ]Fe Fe Fe Fe Fe V Fe nvhoa102@yahoo.com Chương 8 15 2.1. Thuyết liên kết hóa trị VB: Cơ sở: tương tác cho – nhận e- hóa trị tự do của L AO hóa trị tự do của M [CoF6] 3- : phức bát diện, thuận từ Co3+ : 3d64s 4p4d Phức bát diện lai hóa sp3d2 3d 4d 4p4s .. .. .. .. .. .. F - F - F - F - F - F - Co: 3d74s2 II.2. Lý thuyết tạo phức Phức spin cao (phức obital ngoại) nvhoa102@yahoo.com Chương 8 16 Số phối trí Hình dạng phức chất Obitan lai hoá của M Lai hoá Ví dụ 2 Đường thẳng s, pz sp [Ag(NH3)2] + 3 Tam giác phẳng s, px, py sp 2 [HgI3] - 4 Tứ diện s, px, py, pz sp 3 [FeBr4] 2- 4 Vuông phẳng s, px, py, dx2-y2 dsp 2 [Ni(CN)4] 2- 5 Tháp tam giác kép s, px, py, pz, dz2 sp 3d [CuCl5] 3- 5 Tháp hình vuông s, px, py, pz, dx2-y2 dsp 3 [Ni(CN)5] 3- 6 Bát diện s, px, py, pz, dz2, dx2-y2 sp 3d2 [Co(NH3)6] 3+ 6 Lăng trụ tam giác s, dxy, dxz, dyz, dz2, dx2-y2 Hoặc s, px, py, pz, dxy, dxz d5s Hoặc d2sp3 [ZrMe6] 2- nvhoa102@yahoo.com Chương 8 17 Số phối trí Hình dạng phức chất Obitan lai hoá của M Lai hoá Ví dụ 7 Tháp ngũ diện kép s, px, py, pz, dxy, dx2-y2, dz2 d3sp3 [V(CN)7] 4- 7 Lăng trụ tam giác đơn chóp s, px, py, pz, dxy, dxz, dz2 sp 3d3 [NbF7] 2- 8 Lập phương s, px, py, pz, dxy, dxz, dyz, fxyz fsp3d3 [PaF8] 3- 8 Đối lăng trụ hình vuông (Square antiprismatic) s, px, py, pz, dz2, dxy, dxz, dyz d4sp3 [Mo(CN)8] 4- 8 12 mặt tam giác s, px, py, pz, dxy, dxz, dyz, dx2-y2 sp3d4 [TaF8] 3- 9 Lăng trụ tam giác tam chóp s, px, py, pz, dxy, dxz, dyz, dz2, dx2-y2 sp3d5 [ReH9] 2- nvhoa102@yahoo.com Chương 8 18 [Ag(NH3)2] + [Cu(CN)3] 2-Tam giác phẳng Đường thẳng Hình dạng phức Ví dụ nvhoa102@yahoo.com Chương 8 19 Hình dạng phức Ví dụ Tứ diện Hình vuông phẳng cis-PtCl2(NH3)2 nvhoa102@yahoo.com Chương 8 20 Tháp tam giác Tháp hình vuông Lăng trụ tam giác Bát diện nvhoa102@yahoo.com Chương 8 21 Tháp ngũ diện kép Lăng trụ tam giác đơn chóp nvhoa102@yahoo.com Chương 8 22 Đối lăng trụ hình vuông 12 mặt tam giác Lăng trụ tam giác tam chóp Lập phương nvhoa102@yahoo.com Chương 8 23 [Co(NH3)6] 3+ : phức bát diện, nghịch từ Giải thích sự tạo thành phức chất: [Zn(NH3)4] 2+ : phức tứ diện, nghịch từ [NiCl4] 2- : phức tứ diện, thuận từ [Ni(CN)4] 2- : phức hình vuông, nghịch từ [PtCl4] 2- : phức hình vuông, nghịch từ [Ag(NH3)2] + : [Cu(CN)3] 2- : nvhoa102@yahoo.com Chương 8 24 2.2. Thuyết trường tinh thể Cơ sở: Tương tác tĩnh điện M : xét AO (bị L ảnh hưởng) L : tác động lên AO của M Xét obital (n-1)d của chất tạo phức: d d nvhoa102@yahoo.com Chương 8 25 E AO Nguyên tử hoặc ion tự do E 0 E AO d trong đối xứng cầu 1/5E 0 Tách mức năng lượng d z y x z y x nvhoa102@yahoo.com Chương 8 26 Phối trí bát diện [CoCl 3 (NH 3 ) 3 ] [Fe(CN) 6 ] 3- nvhoa102@yahoo.com Chương 8 27 Phối trí tứ diện ion tự do Sự tách mức năng lượng các obitan d trong trường tứ diện dxy dxz dyz dz2 dx2 – y2 z y x z y x z y x z y x z y x [VCl 4 ] - Phối trí lập phương x z y nvhoa102@yahoo.com Chương 8 28 Phối trí hình vuoâng y x z nvhoa102@yahoo.com Chương 8 29 - Điện tích hạt nhân của M (trong cùng nhóm) - Số oxi hóa của M - Điện trường của L: CO CN->NO2 - > NH3>NCS - > H2O>C2O4 2->OH->F->SCN->Cl->Br->I- Mạnh Trung bình Yếu - Số phối trí - Sự phối trí Các yếu tố ảnh hưởng đến : nvhoa102@yahoo.com Chương 8 30 1cm-1 = 11,96 J/mol 1eV = 96485 J/mol nvhoa102@yahoo.com Chương 8 31 Xét chất tạo phức: AO tạo lk, số e- tạo liên kết Xét số phối trí: - bát diện (n =6) - tứ diện (n=4) d d d d - Xét phức có mạnh hay yếu: sắp xếp e- vào AO mới L yếu (H2O, OH -, F-, Cl-) : theo qui tắc Hund L mạnh (CO, CN-, NO2 -) xếp e- xong ở AO thấp rồi mới lên AO cao Cấu trúc electron hoá trị của ion chất tạo phức theo thuyết trường tinh thể nvhoa102@yahoo.com Chương 8 32 Ví dụ: Xét cấu hình electron hóa trị của phức [CoF6] 3- theo thuyết trường tinh thể Co: 3d74s2 Co3+: 3d6 Số e- hóa trị là 6 Số phối tử 6 trường bát diện Phối tử là F- trường bát diện yếu: sắp xếp e- theo qui tắc Hund. d d d d nvhoa102@yahoo.com Chương 8 33 Xét cấu hình electron hóa trị của các phức sau theo thuyết trường tinh thể [Fe(H2O)6] +3 [Fe(CN)6] -3 [NiCl4] -2 [Cr(CN)6] -3 [Co(H2O)6] +2 nvhoa102@yahoo.com Chương 8 34 d d = 2,48 eV Ion Ti3+ tự do Ion [Ti(H2O)6] 3+ màu tím Màu sắc của phức chất nvhoa102@yahoo.com Chương 8 35 2.3. Thuyết orbital phân tử MO Cơ sở: Phức chất : thể thống nhất gồm M và L Khảo sát trên cơ sở cấu trúc electron của M và L Liên kết giữa M và L tạo thành do sự che phủ giữa các hóa trị hóa trị của chúng. nvhoa102@yahoo.com Chương 8 36 Phức bát diện không có liên kết [ML6] n+ nvhoa102@yahoo.com Chương 8 37 Co3+ Co 3+ 6F- 6NH3 Phức bát diện không có liên kết MO [CoF6] 3- MO [Co(NH3)6] 3+ nvhoa102@yahoo.com Chương 8 38 Phức bát diện có liên kết bổ sung Điều kiện: Các AO d của M n+ có tính đối xứng với các obital của L. Các obital của L có khả năng che phủ với AO d: AO p và d MO và * nvhoa102@yahoo.com Chương 8 39 khi obital của L có năng lượng cao hơn AO d của M n+ tương tác cho M L x2-y2=z2 xy= xz = yz *x2-y2= * z2 *xy= * xz= * yz nvhoa102@yahoo.com Chương 8 40 khi obital của L có năng lượng thấp hơn AO d của M n+ tương tác cho – nhận M L *xy= * xz= * yz x2-y2= z2 xy= xz = yz *x2-y2= * z2 nvhoa102@yahoo.com Chương 8 41 1.Gọi tên các phức chất sau: [Zn(OH)4] 2- [Al(OH)4] - [CuCl2] - [AuCl4] - [Co(NH3)6] 2+ [Fe(H2O)6] 2+ [Ni(H2O)6] 2+ [Fe(H2O)6]SO4 K4[FeF6] K3[Cr(OH)6] BÀI TẬP 2.Viết công thức các phức chất sau: Ion hexa xyano ferat (II) Hexa aquo crom (II) sunfat Kali hexa floro ferat (II) Kali hexa xiano ferat (III) Ion tetra hidroxo cuprat (II) Kali hexa hidroxo ferat (III) Natri tetra cloro cobanat (II) Hexa ammin niken (II) clorua nvhoa102@yahoo.com Chương 8 42 3. Cho biết độ tan của AgI (TAgI = 8,3.10 -17) trong dung dịch NH3 1M. Biết Kb [Ag(NH3)2]+ = 10 8. 4. Xác định thế điện cực của Ag+/Ag khi cho NaCN vào dung dịch Ag(NO3)2 1M. Biết 0 Ag+/Ag = 0,8V và [Ag(CN)2]- = 7,8.1019. (ĐS: - 0,37 V) 5.Xét sự tạo thành phức theo thuyết trường tinh thể, MO [Cr(H2O)6] 2+ [Fe(H2O)6] 3+ [Cr(NH3)6] 2+ [Fe(CN)6] 4- [Co(CN)6] 3- [Mn(CN)6] 4- [MnF6] 4- [FeCl4] 2- Cho biết từ tính của phức? BÀI TẬP
File đính kèm:
 bai_giang_hoa_dai_cuong_chuong_8_nguyen_to_chuyen_tiep.pdf
bai_giang_hoa_dai_cuong_chuong_8_nguyen_to_chuyen_tiep.pdf

