Hóa vô cơ A - Chương VII: Các nguyên tố phân nhóm VIA (x)
Cấu hình electron hóa trị: ns2np4
X + 2e- = X2- (liên kết ion hoặc CHT), thể
hiện tính oxi hóa.
- Tính phi kim, tính oxi hóa giảm từ O2 đến Po.
- Từ S trở đi, có khả năng nhường e thể hiện tính
khử.
- Từ S trở đi, do có ON d còn trống tạo nhiều số
oxi hóa dương (+2, +4, +6).
Bạn đang xem 20 trang mẫu của tài liệu "Hóa vô cơ A - Chương VII: Các nguyên tố phân nhóm VIA (x)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Hóa vô cơ A - Chương VII: Các nguyên tố phân nhóm VIA (x)
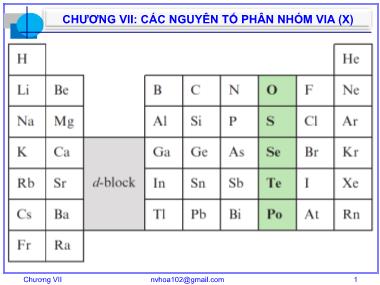
Chương VII nvhoa102@gmail.com 1 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 2 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Oxi 2. Lưu huỳnh II. HỢP CHẤT 1. Hợp chất của oxi 2. Hợp chất của lưu huỳnh TÀI LIỆU [1] – Tập 2, Chương 7: trang 218 – 250 [2] – Chương 4: trang 61 – 104 [3] – Phần II, Chương 4: trang 274 – 330 [4] – Chapter 16: page 546 – 590 Chương VII nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2np4 X + 2e- = X2- (liên kết ion hoặc CHT), thể hiện tính oxi hóa. - Tính phi kim, tính oxi hóa giảm từ O2 đến Po. - Từ S trở đi, có khả năng nhường e thể hiện tính khử. - Từ S trở đi, do có ON d còn trống tạo nhiều số oxi hóa dương (+2, +4, +6). - Các H2X có tính bền nên tính khử, tính axit . CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 4 I ĐƠN CHẤT 1 Oxi (χ = 3,44) Có hai thù hình: dioxi (O2) – oxi và trioxi (O3) – ozôn 1.1 Oxi - Khí không màu, không mùi, không vị. - Ít tan trong nước, tan nhiều hơn trong các dung môi hữu cơ. - Nhiệt độ nóng chảy và nhiệt độ sôi thấp. - Duy trì sự cháy, cần cho sự sống. CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 5 - Bậc liên kết bằng 2, năng lượng liên kết lớn (494 kJ/mol) O2 khá bền, không phân cực. - Là chất oxi hóa mạnh: O2 + 2H2 2H2O (nổ) O2 + 2NO 2NO2 (tức thì) 2Fe + 3/2O2 + nH2O Fe2O3.nH2O (rất chậm) (gỉ sắt) - Sự tạo thành O2 trong tự nhiên: 6CO2 + 6H2O C6H12O6 + 6O2 Diệp lục Ánh sáng CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 6 - Điều chế: Trong PTN: Nhiệt phân các hợp chất giầu oxi: KClO3 KCl + O2 2KNO3 2KNO2 + O2 2KMnO4 K2MnO4 + MnO2 + O2 Trong công nghiệp: • Chưng cất phân đoạn không khí lỏng. • Điện phân dung dịch kiềm. • Rây phân tử. to, MnO2 to to CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 7 1.2 Ozôn Bậc liên kết bằng 1,5. Momen lưỡng cực = 0,52 D So với oxi, ozôn có: - tonc và t o s thấp nhưng cao hơn. - Tan trong nước nhiều hơn. - Kém bền hơn: O3 O2 + O - Hoạt tính hóa học mạnh hơn: 2Ag + O3 Ag2O + O2 2KI + O3 + H2O I2 + 2KOH + O2 * CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 8 Sự tạo thành O3: Điều chế: Phóng điện êm qua O2 ở 30.000 V hay tác dụng các bức xạ sóng ngắn lên oxi: 3O2 2O3 Trong tự nhiên: O2 2O (tia tử ngoại = 160 – 240 nm ) O + O2 O3 O3 O + O2 (tia tử ngoại = 240 – 360 nm) (Vành đai bảo vệ trái đất) hυ hυ 2 3 O + O O 160 – 240 nm 240 – 360 nm CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 9 The electromagnetic spectrum CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 10 Hiện tượng suy giảm tầng ozôn: Nguyên nhân: Freon (CFCl3, CF2Cl2, CHClF2); NOx: CF2Cl2 CF2Cl + Cl ( = 190 – 225 nm) Cl + O3 ClO + O2 ClO + O Cl + O2 O3 + O 2O2 hυ CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 11 > 95,60C < 95,60C S ⇌ S Chương VII nvhoa102@gmail.com 12 2 Lưu huỳnh (χ = 2,58) 2.1 Tính chất vật lý - Có nhiều dạng thù hình: • tophòng – S8: Tà phương (S ) và đơn tà (S ) • ∼ 200 oC – S • ∼ 450 oC – S6 • ∼ 650 oC – S4 • ∼ 900 oC – S2 • > 1500 oC – S CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 13 - Quá trình nấu chảy S: S , S 112,8 oC hay 119,3 oC S8 lỏng, vàng >160 oC Lỏng, nâu, nhớt 160oC – 200oC Nhựa dẻo, nâu đen >200 oC Độ nhớt 444,6 oC Hơi, vàng da cam, S6 S4 650 oC S2 ∼900 oC S >1500 oC CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 14 - Lưu huỳnh dòn, cách điện, không tan trong nước, tan trong benzene, dầu hỏa, CS2. 2.2 Tính chất hóa học: S là phi kim điển hình, thể hiện tính oxi hóa và khử: Tính oxi hóa: Slỏng + H2 ⇌ H2S ; S + Fe FeS Tính khử: S + O2 SO2 S + 2H2SO4 đặc nóng 3SO2 + 2H2O ~3000C >3000C to CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 15 2.3 Trạng thái tự nhiên, điều chế, ứng dụng Trạng thái tự nhiên: • Đơn chất. • Hợp chất: dạng sunfua (FeS2, FeCuS2 ), dạng sunfat (CaSO4.2H2O, BaSO4 ) S đơn chất Quặng pyrit Khoáng baritin CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 16 Điều chế: FeS2 FeS + S Ứng dụng: • Sản xuất H2SO4 • Lưu hóa cao su • Sản xuất CS2 • Sản xuất thuốc trừ sâu. Compressed air under a pressure of 20-25 atmosphere Super heated water at 1700C > 600 oC CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 17 II HỢP CHẤT 1 Hợp chất của oxi • Oxit – O2- • Peoxit – (O2) 2- có cấu tạo cầu – O – O – • Superoxit – (O2) - • Ozonit – (O3) - • Các hợp chất có số oxi hóa dương: (O2) 2+; O2+ - Hợp chất peoxit quan trọng là H2O2 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 18 H2O2 (hydro peoxit, oxi già): - Chất lỏng, không màu, tan vô hạn trong nước. - Không bền (gây nổ) bởi nhiệt độ, ánh sáng, xúc tác (MnO2, Ag ): H2O2 H2O + O - Tính axit yếu: H2O2 + H2O ⇌ H3O + + HO2 - K = 2,4.10-12 H 2 O 2 + 2NaOH Na 2 O 2 + 2H 2 O H 2 O 2 + Ba(OH) 2 BaO2 + 2H2O H2O2 pha hơi H2O2 pha rắn CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 19 - Tính oxi hóa (đặc trưng): H2O2 + 2H + + 2e ⇌ 2H2O, 0 = +1,78 V 4H2O2 + PbS PbSO4 + 4H2O H2O2 + 2KI 2KOH + I2 - Tính khử: H2O2 - 2e ⇌ O2 + 2H + , 0 = +0,68 V 5H2O2 + 2KMnO4 + 3H2SO4 2MnSO4 + 5O2 + K2SO4 + 8H2O * CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 20 - Điều chế: • Trong PTN: BaO2 + H2SO4 H2O2 + BaSO4 • Trong CN: Điện phân dung dịch H2SO4 50%: 2HSO4 ̅ 2e H2S2O8 H2S2O8 + 2H2O 2H2SO4 + H2O2 Phương pháp anky antroquinol: Pd or Ni CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 21 2 Hợp chất của lưu huỳnh 2.1 Hợp chất S (-2) Dihydro sunfua (H2S): - Khí, không màu, mùi trứng thối, rất độc, ít tan trong nước ( = 1,02 D), tan nhiều hơn trong các dung môi hữu cơ. - Trong dung dịch nước, có tính axit yếu: H2S + H2O ⇌ H3O + + HS- K1 = 10 -7 HS- + H2O ⇌ H3O + + S2 K2 = 10 -19 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 22 - Có tính khử mạnh: 2H2S + O2 2S↓ + 2H2O * (thiếu O2, t o thấp) 2H2S + 3O2 2SO2 + 2H2O (dư oxy, t o) H2S + 2O2 H2SO4 (dư O2, t o,xt, hơi ẩm) H2S + 2FeCl3 S↓ + 2FeCl2 + 2HCl 5H2S + 2KMnO4 + 3H2SO4 5S+2MnSO4 + K2SO4 + 8H2O H2S + 3H2SO4(đặc, nóng) 4SO2 + 4H2O H2S + 4Br2 + 4H2O H2SO4 + 8HBr CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 23 Muối sunfua: - Phân loại muối sunfua theo độ tan: • Sunfua tan trong nước: Na2S, BaS, Al2S3, Cr2S3 • Suafua tan trong axit loãng: MnS, FeS, ZnS • Sunfua tan trong axit có tính oxi hóa mạnh: CuS, Ag2S, HgS, PbS - Muối sunfua có tính khử mạnh: 2ZnS + 3O2 2ZnO + 2SO2 3S2 + 8NO3 ̅ + 8H+ 3SO4 2– + 8NO + 4H2O CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 24 - Muối sunfua axit, bazo, lưỡng tính: SiS2 + 3H2O ⇌ H2SiO3 + 2H2S Na2S + H2O ⇌ NaHS + NaOH Cr2S3 + 6H2O ⇌ 2Cr(OH)3 + 3H2S 2.2 Hợp chất S(+4): SO2, H2SO3, SO3 2- SO2 - Anhydrit sunfurơ: SO2 + H2O ⇌ H2SO3 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 25 - Oxit axit: SO2 + 2NaOH Na2SO3 + H2O H2SO3 (SO2.xH2O) - Không bền, có tính axit trung bình với Ka1=2.10 -2, Ka2=6.10 -6. HSO3 - , SO3 2- - Chúng không bền nhiệt; SO3 2- bền hơn HSO3 -. - Chỉ MeHSO3 và M(HSO3)2 dễ tan và bị thủy phân tạo môi trường axit yếu. - Chỉ Me2SO3 tan và bị thủy phân tạo môi trường kiềm yếu. CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Chương VII nvhoa102@gmail.com 26 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) SO2, HSO3 - và SO3 2- có tính oxi hóa yếu và khử mạnh: - Oxi hóa yếu: SO2 + 2CO S + 2CO2 * Na2SO3 + 2Na2S + 7H2SO4 4S + 6Na2SO4 + 7H2O - Khử đặc trưng: 2SO2 + O2 2SO3 (t o,V2O5) 2Na2SO3 + O2kk 2Na2SO4 Điều chế SO2 trong PTN: NaHSO3 + H2SO4đ NaHSO4 + SO2 + H2O Chương VII nvhoa102@gmail.com 27 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) 2.3 Hợp chất S(+6): SO3, H2SO4, SO4 2- SO3 - Anhydrit sunfuric: SO3 + H2O H2SO4 H o = - 89,12 kJ - Oxi axit: SO3 + 2NaOH Na2SO4 + H2O H2SO4 - Chất lỏng, sánh như dầu, tan vô hạn trong nước và tỏa nhiều nhiệt. - Là dung môi ion hóa mạnh: H2SO4 + H2SO4 ⇌ H3SO4 + + HSO4 - Chương VII nvhoa102@gmail.com 28 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) - H2SO4 tinh khiết không điện ly. - Dung dịch loãng H2SO4 điện ly 2 nấc H +: H2SO4 + H2O ⇌ H3O + + HSO4 - Ka1 = 10 3 HSO4 - + H2O ⇌ H3O + + SO4 2- Ka2 = 10 -2 - Dung dịch đậm đặc nóng có tính oxi hóa mạnh: 2H2SO4 đ + 2Ag → Ag2SO4 + SO2 + 2H2O 2H2SO4 đ + C → CO2 + 2SO2 + 2H2O H2SO4 đ + 2HBr → SO2 + Br2 + 2H2O - Dung dịch đậm đặc nguội làm thụ động Fe,Al,Cr to to to Chương VII nvhoa102@gmail.com 29 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Điều chế H2SO4 trong công nghiệp: Chế tạo SO2: S + O2 → SO2 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 Chuyển hóa SO2 thành SO3: 2SO2 + O2 ⇌ 2SO3 Hấp thu SO3 trong H2SO4 98,3%: SO3 + H2SO4 98,3% → các polisunfuric (oleum) 400 - 550 oC V2O5,Me2O/SiO2 to to Chương VII nvhoa102@gmail.com 30 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) 2.4 Các axit và muối khác của S H2S2O3 và S2O3 2-: - Axit thiosunfuric không bền: H2S2O3 → S + SO2 + H2O Na2S2O3 + H2SO4 → Na2SO4 + SO2 + S + H2O Là axit trung bình mạnh, điện ly 2 nấc H+ với Ka1 = 0,25; Ka2 = 1,8.10 -2. Có tính khử đặc trưng: 2H2S2O3 + I2 → H2S4O6 + 2HI 0 +4 Chương VII nvhoa102@gmail.com 31 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) - Muối thiosunfat (Na2S2O3.5H2O) bền, có tính khử và tạo phức: Na2S2O3 + 4Cl2 + 5H2O → 2NaHSO4 + 8HCl (1) 2Na2S2O3 + I2 → 2NaI + Na2S4O6 (2) 2Na2S2O3 + AgBr → Na3[Ag(S2O3)2] + NaBr (3) Điều chế: Na2SO3 + S → Na2S2O3 (dd bão hòa) Natri tetrathionat to Chương VII nvhoa102@gmail.com 32 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) H2S2O8 và S2O8 2-: - Axit pesunfuric không bền trong nước: H2S2O8 + 2H2O → 2H2SO4 + H2O2 - Muối pesunfat có tính oxi hóa mạnh: 2MnSO4 + 5(NH4)2S2O8 + 8H2O → 2HMnO4 + 5(NH4)2SO4 + 7H2SO4
File đính kèm:
 hoa_vo_co_a_chuong_vii_cac_nguyen_to_phan_nhom_via_x.pdf
hoa_vo_co_a_chuong_vii_cac_nguyen_to_phan_nhom_via_x.pdf

